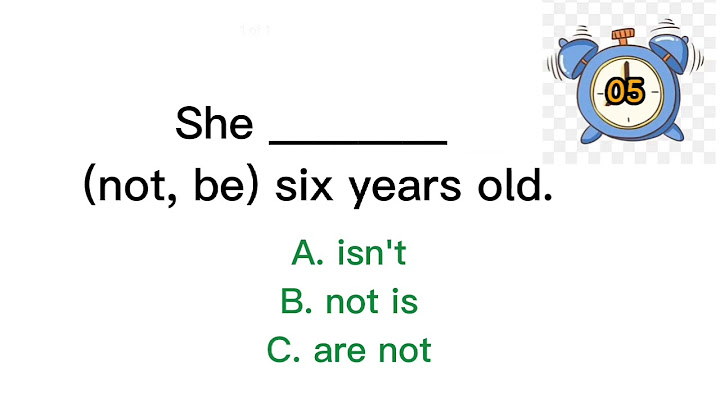\(2\mathop {{H_2}}\limits^0 + \mathop {{O_2}}\limits^0 \to 2\mathop {{H_2}}\limits^{ + 1} \mathop O\limits^{ - 2}\)
1.1.2. Phản ứng phân hủy
1.1.3. Phản ứng thế
1.1.4. Phản ứng trao đổi
Phương pháp giải bài tập Hóa 10 bài 18: Phân loại phản ứng trong hoá học vô cơ rất hay giúp các em nắm vững kiến thức và giải bài tập SGK hoàn chỉnh BÀI 18. PHÂN LOẠI PHẢN ỨNG TRONG HOÁ HỌC VÔ CƠ
1. Phản ứng hoá hợp Tгопg phản ứng hoá hợp. số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi. 4P + O2 →to→to P2O5 2. Phản ứng phân huỷ Trong phản ứng phân huý. số oxi hoá của các nguyên tố có thể thay đổi hoặc không thay đổi. 2Fe(OH)3 →to→to Fe2 O3 + 3H2O 3. Phản ứng thế Trong hoá học vô cơ, phản ứng thế luôn có sự thay đổi số oxi hoá của các nguyên tố. Fe + HCl → FeCl2 + H2 4. Phản ứng trao đổi Trong phản ứng trao đổi, số oxi hoá của các nguyên tố không thay đổi. 2NaOH + CuCl2 → Cu(OH)2 + 2NaCl II. KẾT LUẬN Dựa vào sự thay đổi số oxi hoá, có thể chia phản ứng hoá học thành hai loại :
Các phản ứng thế, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng hoá học này.
Các phản ứng trao đổi, một số phản ứng hoá hợp và một số phản ứng phân huỷ thuộc loại phản ứng hoá học này.
Bài tập liên quan đến phân loại phản ứng trong hóa vô cơ đa phần là các bài tập lý thuyết, để làm tốt bài tập liên quan đến phân loại phản ứng trong hóa vô cơ, học sinh cần ghi nhớ khái niệm về phản ứng hóa hợp, phản ứng phân hủy, phản ứng thế, phản ứng trao đổi, phản ứng oxi hóa khử.
Bài 1 (trang 86 SGK Hóa 10): Cho phản ứng : 2Na + Cl2 → 2NaCl. Trong phản ứng này, nguyên tử natri.
Chọn đáp án đúng Hướng dẫn giải: Chọn A. Bài 2 (trang 86 SGK Hóa 10): Cho phản ứng: Zn + CuCl2 → ZnCl2 + Cu. Trong phản ứng này, 1 mol ion Cu2+;
Chọn đáp án đúng. Hướng dẫn giải: Chọn B. Cu2+ + 2e → Cu ⇒ 1 mol Cu2+ đã nhận 2mol electron. Bài 3 (trang 86 SGK Hóa 10): Cho các phản ứng sau:
Phản ứng nào không phải phản ứng oxi hóa – khử? Hướng dẫn giải: Chọn A. Bài 4 (trang 86 SGK Hóa 10): Dấu hiện để nhận biết một phản ứng oxi hóa – khử:
Chọn đáp án đúng. Hướng dẫn giải: Chọn D. Bài 5 (trang 87 SGK Hóa 10): Trong những phản ứng sau đây, phản ứng nào là phản ứng oxi hóa – khử? Giải thích.
Hướng dẫn giải: Trong những phản ứng trên chỉ có phản ứng c), e), f) là những phản ứng oxi hoá – khử vì có sự thay đối số oxi hoá của các nguyên tố Bài 6 (trang 87 SGK Hóa 10): Lấy ba thí dụ phản ứng hoá hợp thuộc loại phản ứng oxi hoá – khử và ba thí dụ phản ứng hoá hợp không là loại phản ứng oxi hoá – khử. Hướng dẫn giải: Ba thí dụ phản ứng hoá hợp thuộc loại phản ứng oxi hoá – khử : Ba thí dụ phản ứng hoá hợp không thuộc loại phản ứng oxi hoá – khử : CaO + CO2 → СаСОз Na2O + H2O → 2NaOH SO3 + H2O → H2SO4. Bài 7 (trang 87 SGK Hóa 10): Lấy 3 thí dụ phản ứng phân hủy là loại phản ứng oxi hoá – khử và ba thí dụ phản ứng phân hủy không là loại phản ứng oxi hoá – khử. Hướng dẫn giải: Ba thí dụ phản ứng phân hủy là phản ứng oxi hoá – khử : KClO3 →to→to KCl + 3/2 O2↑ 2KMnO4 →to→to K2MnO4 + MnO2 + O2. 2NaNO3 →to→to 2NaNO2 + 2O2 Ba thí dụ phản ứng phân hủy không là phản ứng oxi hoá – khử : Cu(OH)2 →to→toCuO + H2O СаСО3 →to→toCaO + CO2 NH4Cl →to→toNH3 + HCl Bài 8 (trang 87 SGK Hóa 10): Vì sao phản ứng thế luôn luôn là loại phản ứng oxi hoá – khử ? Hướng dẫn giải: Sở dĩ phản ứng thế luôn luôn là loại phản ứng oxi hoá – khử vì trong phản ứng thế, bao giờ cũng có sự thay đổi số oxi hoá của các nguyên tố. |